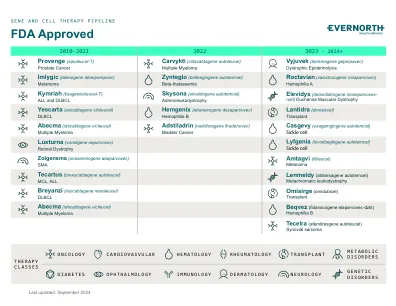
机构名称:
¥ 1.0
I.背景A. Entresto于2015年7月7日,FDA批准了Entresto(NDA 207620)“降低了慢性心力衰竭患者(NYHA II-II-IV类)和减少射血分数的患者心力衰竭的心血管衰竭的风险。” 2为了支持Entresto的原始指示批准,诺华进行了一项单一阶段临床试验,称为“ Paradigm-HF”。 3“ Paradigm-HF是一项跨国,随机的双盲试验,比较了8,442例有症状性慢性心力衰竭(NYHA II – II-IV)和收缩功能障碍(左心室射血分数[(LVEF)]的症状性慢性心力衰竭(NYHA II – II – IV)患者的Entresto和enalapril [(LVEF)]。补充018 5 2020年4月20日,请愿人提交了疗效补充(SNDA 207620/S-018),其中包括请愿人进行的3期临床试验的数据和结果,称为“ Paragon-HF”。 6 Paragon-HF是一项多中心,随机,双盲试验,比较了4,796名与L9()DQG VWUXFWXUDO KHDUW GLVHDVH glvhdvh hlwkhu hlwkhu hlwkhu hlwkhu ohi ohi ohiw dwuldo hqodujhphqw ru ohii ohii ohii ohii hipyprofferfffffffffffffctement。7,2021年2月16日,FDA批准了SNDA 207620/S-018,以更新到Entresto标签,包括与Paragon-HF试验有关的更改。补充批准对指示和用法(1.1)和临床研究(14.1)部分进行了实质性修订,并在整个标签中也进行了其他修订。8 Entresto目前为以下指示:
案卷号FDA-2021-P-1286 | Stat News
主要关键词























![FDA-2021-D-0398]人类基因治疗产品...](/simg/9/9c64d384960491c78e43de88a6f22f4d5f673d84.webp)